für Innere Medizin II
direktion.med2@mri.tum.de
An unserem Zentrum bieten wir Patient*innen mit einer Eosinophilen Ösophagitis (EoE) mehrere Arzneimittelstudien mit topischen Steroiden zur Induktions- und Erhaltungstherapie sowie mit Antikörpern bei EoE, die nicht auf Steroidtherapie anspricht.
Für weitere Informationen wenden Sie sich gerne an uns unter (0 89) 41 40 - 63 94.
ACESO-Studie
Leiden Sie an Schluckbeschwerden verursacht durch eine Entzündung der Speiseröhre, genannt „eosinophile Ösophagitis"? Dann nehmen Sie jetzt an einer klinischen Studie teil.
Worum geht es in der klinischen Studie?
Um die allgemeine Verfügbarkeit eines neuen Medikamentes zu erreichen, ist es notwendig, verschiedene klinische Prüfungen zu durchlaufen. Im Rahmen der ACESO-Studie soll der Nachweis der verbesserten Wirksamkeit und Verträglichkeit eines neuen Medikaments (ESO-101) zur Behandlung von eosinophiler Ösophagitis getestet werden. ESO-101 ist eine neue Darreichungsform eines bereits bekannten entzündungshemmenden Medikaments. Das freigesetzte aktive Medikament ist Mometasonfuroat, ein lokal wirksames Corticosteroid, welches bereits auf dem Markt zur Behandlung von allergischen Erkrankungen wie Asthma angewendet wird.
Ablauf der Behandlung:
Im Rahmen der ACESO-Studie müssen Sie innerhalb von 6–9 Wochen insgesamt 5 Mal das Studienzentrum besuchen. Im Abstand von ca. 4 Wochen werden 2 Endoskopien durchgeführt, um die Schleimhaut der Speiseröhre zu untersuchen. Bitte planen Sie bei jedem Besuch einen Zeitaufwand von ca. 2 Stunden ein.
Was ist Eso-101?
ESO-101 besteht aus: Becher, Deckel für den Becher, Kapsel in Applikator mit Schutzkappe.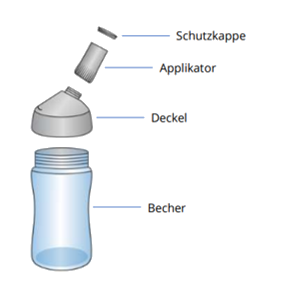
Nach Befüllen des Bechers mit Wasser und Anschrauben der weiteren Teile wird der Applikator mit dem Becher an den Mund angesetzt und die gesamte Flüssigkeit aus dem Becher, ohne diesen abzusetzen, getrunken. Hierbei legt sich ein dünner, auflösbarer Film auf die Speiseröhre, welcher die Studienmedikation freisetzt.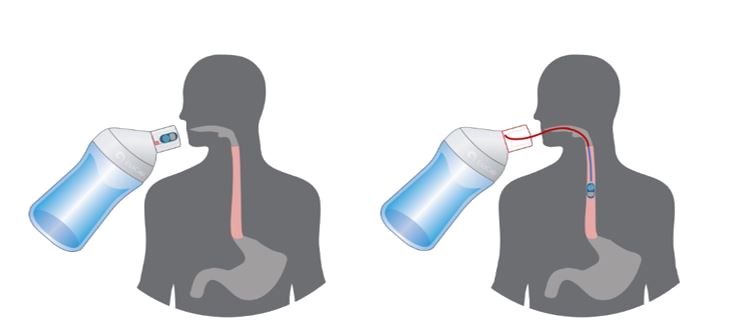
Sollten wir Ihr Interesse geweckt haben, bitten wir Sie um Kontaktaufnahme mit dem Studienzentrum.
Studie BUL-3
Doppel-blinde (DB), randomisierte, multizentrische, Placebo-kontrollierte, klinische Phase-III-Studie zum Vergleich von Parallelgruppen mit einer episodischen und einer kontinuierlichen Remissionserhaltungstherapie einer eosinophilen Ösophagitis (EoE) über 48 Wochen mit Placebo.
Falls Patient*innen vor der Erhaltungstherapie noch nicht in klinischer und histologischer Remission ihrer EoE sein sollten, haben die Patient*innen die Möglichkeit vor der DB-Behandlungsphase eine optionale offene Phase über 6 Wochen zu durchlaufen.
Zusätzlich haben die Patient*innen bei fehlender Wirksamkeit der Erhaltungstherapie in der DB-Phase die Option, weitere 6 Wochen eine offene Behandlung zu erhalten.
Prüfmedikamente
Wichtigste Einschlusskriterien
Wichtigste Ausschlusskriterien
Studie BUL-8
Doppel-blinde, doppel-dummy, randomisierte, in parallelen Gruppen durchgeführte Nichtunterlegenheitsstudie der Phase III zum Vergleich der Wirksamkeit und Verträglichkeit einer einmal täglichen Gabe einer 2 mg Budesonid enthaltenden Schmelztablette gegenüber einer zweimal täglichen Gabe einer 1 mg Budesonid enthaltenden Schmelztablette zur Induktion der histologischen Remission bei Erwachsenen mit eosinophiler Ösophagitis.
Wer kann an der Studie teilnehmen?
An der Studie können Erwachsene in einem Alter zwischen 18 und 75 Jahren teilnehmen, die an einer akuten eosinophilen Ösophagitis (EoE) mit klinischen Symptomen und Entzündung der Speiseröhre leiden.
Die Diagnose der eosinophilen Ösophagitis und der Nachweis der Entzündung der Speiseröhre muss zu Studienbeginn anhand von Gewebeproben einer aktuellen Spiegelung der Speiseröhre (und evtl. des Magens und des Dünndarms) durch einen unabhängigen Pathologen bestätigt werden.
Warum wird die Studie durchgeführt?
Mehrere Studien haben gezeigt, dass die Behandlung der EoE mit Budesonid, einem Glukokortikoiden („Kortison"), die klinischen Symptome verbessert und die Entzündung zurückgeht. Budesonid, welches in dieser Studie weiter untersucht wird, wurde auf Grundlage der bisherigen Daten in Form einer Schmelztablette unter dem Namen Jorveza durch die europäische Arzneimittelbehörde zugelassen. Die zur Beherrschung der Symptome empfohlene Dosis beträgt eine 1-mg-Tablette zweimal täglich für 6 bis 12 Wochen.
Mit dieser Studie wird untersucht, ob die Behandlung der akuten EoE auch mit einer einmal täglichen Dosis einer 2-mg-Tablette ähnlich sicher und effektiv ist wie die zweimal tägliche Dosis der 1-mg-Tablette.
Wie wird der Patient/die Patientin behandelt?
Die Studienteilnahme beginnt mit einer bis zu 4-wöchigen Screening-Phase, in welcher die Eignung für die Studienteilnahme überprüft wird. Daran schließt sich eine 6-wöchige Behandlungsphase an mit dem Ziel die Symptome zu bessern und Entzündungszeichen in der Speiseröhre zurückzubilden. Der Patient/die Patientin nimmt täglich morgens und abends die Medizin ein.
Es gibt zwei Behandlungsgruppen mit einer täglichen Dosis von 2 mg Budesonid:
Die Verteilung der zwei Gruppen ist 1:1, d.h. alle Patienten erhalten Budesonid. Weder Arzt/Ärztin noch Patient*in wissen, ob die Tagesdosis in einer Gabe oder in zwei Gaben erreicht wird. Daher wird diese Studie „doppelblind" genannt. Nach der Behandlungsphase findet nach einer 4-wöchigen Nachbeobachtungszeit eine Abschluss-Visite statt.
Die Studiendauer beträgt mindestens 11 Wochen und maximal 14 Wochen.
Führt die Behandlung zu den klassischen Nebenwirkungen von Kortikosteroiden?
Budesonid zeigt aufgrund seiner chemischen Eigenschaften nicht die klassischen Nebenwirkungen von Kortikosteroiden bzw. nicht in der gleichen Intensität. Wie bei jeder Therapie können aber auch bei einer Behandlung mit Budesonid Nebenwirkungen auftreten. Im Rahmen der Studie werden Sie daher engmaschig überwacht, so dass eventuell auftretende Nebenwirkungen rasch behandelt werden können.
Werden in der Studie Endoskopien (Spiegelungen) durchgeführt?
Ja, 2-mal. Im Rahmen der Studie ist zum Studieneinschluss und zum Abschluss der doppelblinden Behandlung eine Spiegelung (Endoskopie) der Speiseröhre vorgesehen. Wurde die Erkrankung im Jahr vor Beginn der Studie mittels einer Magenspiegelung bestätigt, reicht für die Eingangsuntersuchung der Studie eine Spiegelung der Speiseröhre. Andernfalls muss eine Magenspiegelung durchgeführt werden.
Während der Studienteilnahme führen Studienteilnehmende täglich ein elektronisches Tagebuch zur Erfassung ihrer Beschwerden.
Studienteilnehmende bekommen die Fahrtkosten erstattet.
Studie CALY
Klinische, multizentrische SAD- und MAD-Studie zur Untersuchung der Sicherheit, Verträglichkeit, Pharmakokinetik und Pharmakodynamik einer IV-Behandlung mit CALY-002 bei gesunden Probanden und bei Patienten mit Zöliakie und mit Eosinophiler Ösophagitis
Celgene-Studie
Bei dieser klinischen Prüfung (der „Studie“) wird beurteilt, wie sicher und wirksam ein Prüfpräparat für Teilnehmer mit eosinophiler Ösophagitis (EoE) ist. Bei dem Prüfpräparat handelt es sich um ein Biologikum, einen sogenannten monoklonalen Antikörper, und wir untersuchen hier, ob es verhindern kann, dass das körpereigene Immunsystem (das Abwehrsystem) auf allergieauslösende Stoffe reagiert, die möglicherweise EoE verursachen. Wenn das funktioniert, kann es möglicherweise verhindern, dass der Ösophagus (die Speiseröhre) anschwillt, sodass Patienten mit EoE leichter Nahrung und Getränke zu sich nehmen können.
Das Prüfpräparat
Beim Prüfpräparat handelt sich um eine Injektion (eine Spritze), die über eine kleine Nadel verabreicht wird, die direkt unter der Haut platziert wird. Einmal in der Woche werden zwei Spritzen in Folge (nacheinander) verabreicht.
Der Prüfarzt bespricht mit Ihnen, welche Optionen Sie für den Erhalt des Prüfpräparats haben, um die beste Option für Ihre Situation zu finden. Die möglichen Optionen sind:
Sie oder Ihr Betreuer werden entsprechend geschult, wenn Sie sich entscheiden, das Prüfpräparat zuhause zu injizieren (zu spritzen).
Komme ich für die klinische Prüfung infrage?
Sie können für die Teilnahme an der Studie in Frage kommen, wenn Sie ein Mann oder eine Frau im Alter von 18 bis 75 Jahren sind und Folgendes auf Sie zutrifft:
Es gelten weitere Voraussetzungen für die Teilnahme, die der Prüfarzt mit Ihnen besprechen wird.
> Informationen zur Studie (PDF)
Studie CROSSING
A Randomized, Double-Blind, Parallel-Group, Placebo-Controlled Phase III Efficacy and Safety Study of Tezepelumab in Patients with Eosinophilic Esophagitis (CROSSING)
Informationen für Patient*innen:
> Flyer_Kurzversion (PDF)
> Flyer_Langversion (PDF)
Informationen für Ärzte/Ärztinnen: